西安交大赵永席、刘必武教授团队通过冷冻-解冻实现功能核酸在液固传感界面的有序自组装
DNA界面传感技术在医学诊断、环境检测和生物安全等应用中具有重要意义。精确控制DNA分子在界面的吸附与组装是实现高效传感的关键。传统方法中,DNA分子在液固界面通过化学反应或吸附作用,形成分子识别层。然而,功能DNA通常为单链结构,修饰过程中易发生非特异性吸附作用,导致界面上DNA构象难以控制,从而影响传感性能。
针对上述挑战,西安交通大学赵永席教授和刘必武教授团队通过简单的冷冻-解冻方法,将功能DNA分子浓缩到金电极表面,实现了DNA在液固界面的高度均一自组装,显著提高了DNA电化学传感器的稳定性和靶标识别能力。作者通过拉曼光谱、共聚焦荧光成像、方波伏安法和电化学阻抗谱等方法,证明了冷冻可将单链DNA分子从无规则的卷曲构象拉伸至延伸构象,确保在自组装过程中Au-S键占主导地位,最终使巯基DNA以直立构象固定在金电极表面。
巯基小分子(如6-巯基己醇,MCH)常作为回填剂用来调控金表面DNA的构象。然而,前期研究表明,常规方法室温下制备的DNA分子层,在引入MCH后容易发生结构重排,导致传感性能差,难以重复。作者发现,通过冷冻形成的DNA自组装层高度均一,可有效消除电化学阻抗谱测量中的背景信号偏移问题,表现出优异的批间一致性和长期稳定性。此外,冷冻定向组装的DNA传感界面在复杂生物样本中具有更高的稳定性。
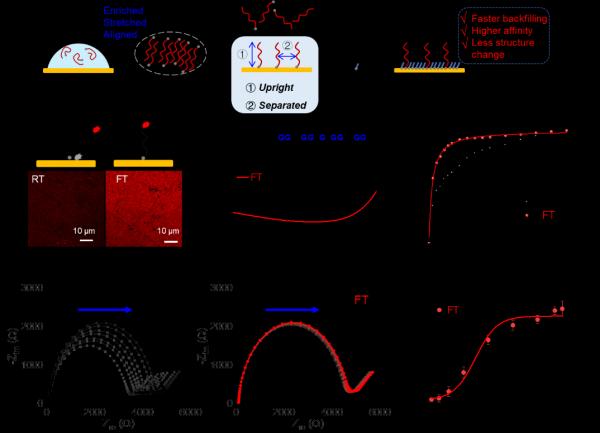
图1 冷冻介导的DNA界面自组装
高度均一的自组装层有效降低了DNA同靶标结合的能量壁垒,提高了DNA传感界面的分子识别能力,为复杂环境下DNA、药物和蛋白分子的高灵敏检测提供了保障。这项研究不仅为DNA电化学传感界面的调控提供了一种简单、有效的方法,同时揭示了相变过程中DNA在液固界面的独特分子行为。此外,该方法还可以扩展到其它DNA传感体系,如场效应晶体管,表面等离子体共振和拉曼传感器等。
该工作近期以“Highly Uniform DNA Monolayers Generated by Freezing‐Directed Assembly on Gold Surfaces Enable Robust Electrochemical Sensing in Whole Blood”为题发表在《德国应用化学》(Angewandte Chemie International Edition)上(DOI: 10.1002/ange.202312975),西安交通大学生命学院为第一通讯单位,前沿科学技术学院为共同通讯单位,生命学院博士生李正连为第一作者,赵永席教授和刘必武教授为共同通讯作者。该工作受到了国家自然科学基金、西安交通大学青年拔尖人才支持计划、陕西省重点研发计划和陕西省创新能力支撑计划的支持,也得到了西安交通大学分析测试共享中心的大力支持。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/ange.202312975
 广州研究院召开学生座谈会
广州研究院召开学生座谈会 海棠4号书院“传承经典国粹,共绘红色印记”国庆手工特别活动圆满结束
海棠4号书院“传承经典国粹,共绘红色印记”国庆手工特别活动圆满结束