西安交大医工交叉团队首次实现力-化协同治疗特应性皮炎
特应性皮炎(Atopic dermatitis, AD)是一种慢性炎症性皮肤病,通常伴有严重的瘙痒。患者由于瘙痒而产生的不由自主搔抓是AD皮肤炎症加重和持续的重要原因。一方面,搔抓产生的力学刺激会促进皮肤细胞分泌TSLP等炎症因子,这会增强AD的炎症,形成“痒挠循环”;另一方面,搔抓产生的力学刺激会直接破坏皮肤屏障,从而增强细菌及过敏原在皮肤组织中的浸润,进而加重炎症。此外,AD中急性炎症导致的氧化应激和力学搔抓的作用是高度耦合的:剧烈抓挠可增强氧化应激并导致急性炎症,而氧化应激介导的炎症可引起细胞对力学刺激的敏化,从而增强搔抓下细胞的炎症反应。现有的AD治疗途径侧重于使用类固醇药物和抗组胺药减轻氧化应激与急性炎症,而针对搔抓的治疗往往被忽视,力-化协同治疗AD的效果同样不清楚。
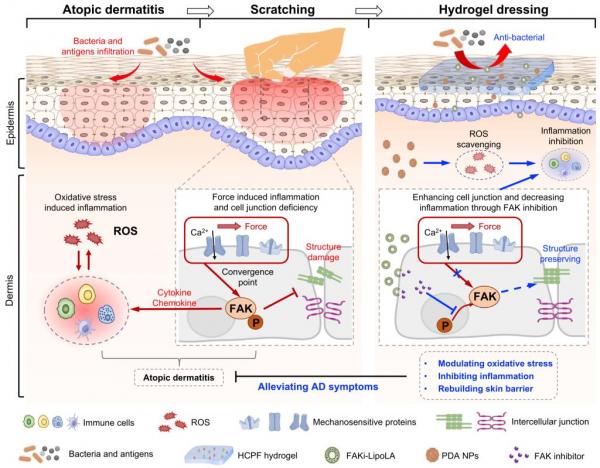
图1 力-化协同治疗特应性皮炎的水凝胶敷料示意图
针对上述问题,西安交通大学生命科学院与技术学院仿生工程与生物力学研究所(BEBC)以交大“大医科+强工科”模式为载体,充分利用多学科交叉和理工医融合的优势,与西安交通大学第二附属医院皮肤科耿松梅教授团队合作,基于力学、材料学、皮肤病学等多学科交叉开发了一种多功能水凝胶皮肤敷料,首次实现了力-化协同治疗特应性皮炎。
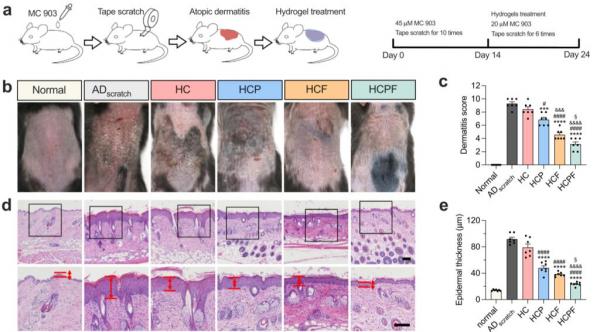
图2 力-化协同治疗的HCPF水凝胶敷料可以缓解AD症状
该工作证明了力学信号通路关键蛋白黏着斑激酶(Focal adhesion kinase, FAK)磷酸化的增强与搔抓有关。在AD小鼠模型中,力学搔抓不仅加重了AD症状,同时增强了组织中磷酸化FAK的水平。随后,团队开发了一种基于硼酸酯的粘性、可拉伸、可自愈的多功能水凝胶敷料(HCPF),负载了用于清除活性氧的聚多巴胺纳米颗粒(PDA NPs)和脂质体装载的FAK抑制剂(FAKi-lipo)以协同治疗AD。这种具有自愈性和抗菌性的水凝胶适用于AD皮肤独特的搔抓和细菌环境。在细胞水平上,通过抑制FAK阻断细胞力学信号转导可以有效减少大应变拉伸导致的炎症因子分泌以及细胞间连接关键蛋白E-Cadherin的破坏。在动物水平上,FAK抑制可以减少搔抓下皮肤屏障的破损以及皮肤的炎症水平。整合FAK抑制和ROS清除的HCPF水凝胶敷料以力-化协同的方式取得了最佳的AD治疗效果。
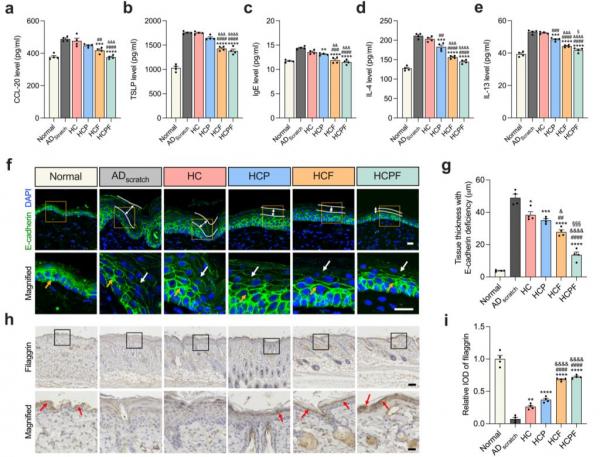
图3 抑制FAK磷酸化可以减少搔抓导致的皮肤屏障损伤
该工作以“集成FAK抑制和ROS清除功能的水凝胶敷料用于特应性皮炎的力-化协同治疗” (Hydrogel dressing integrating FAK inhibition and ROS scavenging for mechano-chemical treatment of atopic dermatitis)为题,在《自然·通讯》(Nature Communications)上在线发表。西安交通大学生物医学信息工程教育部重点实验室为论文第一作者单位和通讯作者单位。文章第一作者为西安交通大学生命学院贾渊博博士和西安交通大学第二附属医院博士生胡佳辉,通讯作者为西安交通大学生命学院徐峰教授和西安交通大学第二附属医院皮肤科耿松梅教授。文章其他作者包括博士生安克莉、赵强、党阳,西安交通大学生命学院刘灏副教授和魏钊副教授。该工作得到了国家自然科学基金、西安交通大学青年人才支持计划等项目的资助。
西安交通大学仿生工程与生物力学研究所(BEBC)围绕“科学研究-技术研发-工程应用-临床推广”的学术思想和“临床问题(BED)-实验室研究(BENCH)-临床应用(BED)”的研究思路,在力学微环境领域开展了从组织到细胞和分子尺度的多尺度生物热-力-电耦合学等基础和应用研究,为阐明重大疾病的发病机理和临床诊疗提供有效的理论指导和技术方案。特别是近年来,在生物力学和力学生物学的研究基础上,通过工程学手段,将不同尺度的力学调控引入疾病治疗,开展了一系列基于生物力学和力生物学的力医学(mechanomedicine)研究,相关代表性研究成果发表于Nature Materials(2017,2022)、Nature Chemistry(2019)、Nature Biomedical Engineering(2020,2021)、PNAS (2022,2023)、Nature Communications(2022,2021)、Science Advances(2019)等期刊。
论文链接:https://www.nature.com/articles/s41467-023-38209-x
BEBC网站主页:http://bebc.xjtu.edu.cn/
 青春献热血 挽臂为三秦——西安交通大学红十字协会、宗濂书院团委开展“血车进校园”活动
青春献热血 挽臂为三秦——西安交通大学红十字协会、宗濂书院团委开展“血车进校园”活动 西安交大微电子学院两项研究成果在CICC 2023发布
西安交大微电子学院两项研究成果在CICC 2023发布