西安交大科研团队在《欧洲分子生物学组织》杂志发表先天性巨结肠症细胞移植治疗新策略
先天性巨结肠症(Hirschsprung’s Disease, HSCR)是常见的小儿消化道畸形之一,其主要病理特征为肠神经节细胞缺如,是新生儿/婴幼儿功能性肠梗阻的主要病因。手术是HSCR现有的主要治疗措施,但在远期内高达1/3患儿发生小肠结肠炎、吻合口瘘/狭窄、感染和慢性便秘等棘手的并发症,严重影响患儿生长发育甚至危及生命。肠神经嵴前体细胞(ENCCs)移植是HSCR潜在根治性治疗策略,但治疗效能不足是目前亟待解决的瓶颈。
西安交通大学第二附属医院小儿外科高亚教授团队近十五年来在多项国家自然科学基金项目的支持下,开展HSCR细胞移植疗实验研究,证实移植细胞可改善模型动物肠功能。为了进一步提高移植效果,率先尝试粪菌移植(FMT)协同ENCCs移植的“双移植”治疗策略,其研究成果于近期在线发表于国际知名学术杂志《欧洲分子生物学组织》(The EMBO Journal),论文题目为《粪菌移植通过SCFA诱导的MEK1/2信号通路增强干细胞移植在先天性巨结肠症模型中的治疗效能》(Fecal microbiota transplantation enhances cell therapy in a rat model of hypoganglionosis by SCFA-induced MEK1/2 signaling pathway”,二附院为第一通讯作者单位,博士研究生田东浩、许文耀为论文共同第一作者,高亚教授、余辉副研究员为论文共同通讯作者。

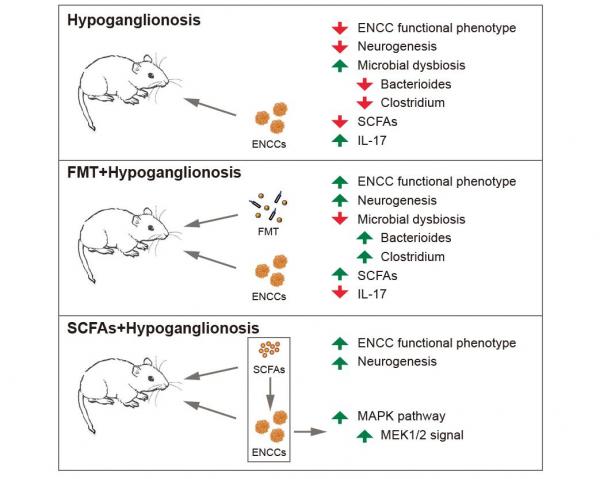
高亚教授团队发现,HSCR动物模型的肠道微环境负向调节ENCCs细胞表型,FMT可有效缓解该不利影响;进一步16S rDNA测序和靶向质谱分析发现,HSCR动物模型肠道中存在菌群失调和短链脂肪酸水平下调,而FMT可增加产短链脂肪酸相关菌属丰度,尤其是Bacteroides、Clostridium菌属,并有效促进细胞移植治疗效能。在此基础上,课题组进一步检测短链脂肪酸干预下ENCCs细胞表型及移植后的治疗效能,并基于转录组测序发现短链脂肪酸协同ENCCs移植诱导肠神经再生的关键机制为MEK1/2信号通路。本研究表明粪菌移植是细胞移植治疗HSCR的有效优化策略,关键机制为短链脂肪酸诱导的MEK1/2信号激活,该发现为HSCR非手术治疗相关研究提供了新方向,并为基于细胞移植诱导肠神经再生相关研究提供新视野。该研究依托于西安交通大学环境与疾病相关基因教育部重点实验室神经生物学研究所完成。
全文链接:https://www.embopress.org/doi/abs/10.15252/embj.2022111139
 第十届华人公共管理学者研讨会在西安交大举行
第十届华人公共管理学者研讨会在西安交大举行 西安特检院到机电工程学院交流座谈
西安特检院到机电工程学院交流座谈