西安交大科研团队在细胞生物力学领域取得新进展
在过去的20年中,越来越多的研究发现“力”存在于生命体-器官-组织-细胞-分子等多个层次。科学家开始关注到力学在胚胎发育的初始阶段、器官形成以及生命晚期的病理过程等生物体各个阶段中发挥着关键作用,发现“力”是塑形生命的关键力量,认为来自于细胞微环境中的多种力学因素对细胞功能的调控具有重要意义。例如,在间充质发育(Mesenchymal development)早期,细胞-细胞间的力学相互作用占主导地位。但是随着发育的进行,细胞开始分化并导致细胞外基质(Extracellular matrix, ECM)的沉积逐渐增加。因此,发育初期占主导的细胞-细胞间的力学相互作用也逐渐过渡到细胞-ECM间的力学相互作用,并达到稳态(图1)。此外,由于在体细胞微环境中包含了复杂的生化及物理因素,如何在体外重现这些动态力学作用已成为该领域研究的难点,这极大限制了探索力学因素对发育过程的影响规律及其作用机制。
针对上述问题,西安交通大学生命学院仿生工程与生物力学研究所林敏教授课题组巧妙地利用DNA具有精确互补配对的特性,通过DNA杂交和链替换反应,实现了对整合素受体(介导细胞-ECM间的力学相互作用)和钙黏素受体(介导细胞-细胞间的力学相互作用)的实时动态调控,在体外模拟了间充质发育过程的动态力学微环境。研究发现,细胞-细胞间的力学相互作用逐渐过渡到细胞-ECM间的力学相互作用的过程,促进了间充质干细胞的转录激活因子(YAP)在细胞核内逐渐累积,并逐渐向成骨分化。针对此现象,进一步揭示了其中的力学机制:整合素受体介导细胞-ECM力学相互作用逐渐占主导并促进间充质干细胞中cofilin的磷酸化,从而使其失去解聚F-actin的能力,导致F-actin累积并形成更多的肌动蛋白帽(actin cap),进而压缩细胞核,使核孔扩张,YAP主动入核速率增加,最终导致YAP核定位,从而调控干细胞的分化。研究也发现这种动态的力学作用可使干细胞形成“力学记忆”:整合素介导的黏附使间充质干细胞的YAP在细胞核内累积,而N-钙黏素介导的黏附介入后,YAP核质比会显著降低。即细胞核内YAP的累积可以被N-钙黏素介导的黏附所逆转。这是继该课题组揭示了整合素受体聚集依赖的细胞力学信号转导机制(Science Advance, 2020,封面论文),力学效应调控间充质干细胞的力学记忆和干性逆转/维持过程(Nature Communications, 2021)和力学黏附强化效应的癌细胞迁移机制(Nature Materials, 2022)之后,在细胞生物力学研究领域的又一新进展。
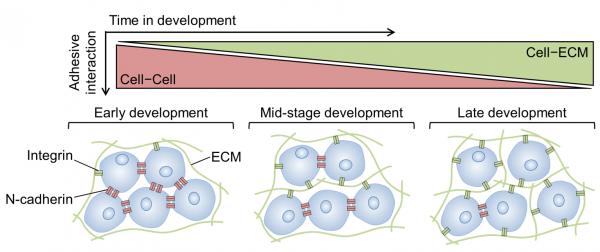
图1 间充质发育过程中动态力学相互作用:
钙黏素介导细胞-细胞间的力学相互作用逐渐过渡到整合素介导细胞-ECM间的力学相互作用
该研究成果以“整合素和N-钙黏素的动态力学黏附通过调节cofilin磷酸化介导间充质干细胞的力学感应”(Programmable integrin and N-cadherin adhesive interactions modulate mechanosensing of mesenchymal stem cells by cofilin phosphorylation)为题,在国际综合性期刊《自然·通讯》(Nature Communications)上在线发表。西安交通大学生物医学信息工程教育部重点实验室为该论文的第一作者单位和通讯作者单位,博士生张政为第一作者,林敏教授为唯一通讯作者。参与本项工作的研究者还包括圣路易斯华盛顿大学Guy Genin教授、南京航空航天大学卢天健教授、西安医学院沙保勇教授、西安交通大学徐峰教授等。
林敏教授围绕细胞力敏感受体介导细胞功能调控的力学生物学机制这一科学问题,通过细胞力学微环境构建及表征,结合力学模型与细胞生物学实验开展了系列研究。近两年,在细胞生物力学领域开展了原创性工作,代表性研究成果发表在《自然·材料》(Nature Materials, 2022)、《自然·通讯》(Nature Communications,2021、2022)、《科学进展》(Science Advances, 2020)等权威期刊上。
论文链接:https://www.nature.com/articles/s41467-022-34424-0
林敏教授主页链接:https://gr.xjtu.edu.cn/en/web/minlin
 学校召开外事工作领导小组会议
学校召开外事工作领导小组会议 西北大学商科发展110周年庆祝大会暨学科发展高端论坛圆满举办
西北大学商科发展110周年庆祝大会暨学科发展高端论坛圆满举办