西安交大研究人员在细胞生物力学领域取得新进展
间充质干细胞是一种多能干细胞,有着易获取、可分化为多种细胞类型(包括神经元、成肌细胞、脂肪细胞、成骨细胞)等优势,在再生医学中有着广泛的应用。在这些应用中,间充质干细胞需要经历从体外扩增到体内移植的过程,其所处的力学环境会发生显著变化。如细胞外基质的刚度从扩增板的GPa量级到体内组织的百Pa~千Pa量级。而力学环境的改变显著影响间充质干细胞的分化方向:硬基质会诱导其趋于成骨分化,软基质则诱导其趋于脂肪分化。此外,干细胞在新环境中的分化行为会表现出对过往力学微环境刺激的时间依赖性。而干细胞通过细胞膜上力学敏感受体感知这种力学环境的变化及其时间依赖性的机理还鲜为人知,限制了间充质干细胞在再生医学中的应用。
近日,西安交通大学生命学院仿生工程与生物力学研究所林敏教授课题组通过引入整合素受体(介导细胞-基质力学相互作用)和钙黏素受体(介导细胞-细胞力学相互作用)的力学拮抗效应,部分逆转了在硬基底上已经分化了的间充质干细胞。实验结果发现,在硬基底上间充质干细胞的转录激活因子(YAP)会在细胞核内累积,而转到软基底后,在基底上锚定的HAVDI多肽与钙黏素受体的力学结合作用下,YAP核质比会显著降低,即细胞核内YAP的累积以及相关的成骨分化标志物可以被HAVDI与钙黏素受体的力学结合所逆转。针对此现象,课题组建立了基于细胞力敏感受体黏附拮抗效应的转录因子重定位模型,提出钙粘素通过拮抗整合素黏附,引致细胞骨架应力卸载,从而恢复了核的弹性变形,导致核孔收缩、YAP主动入核速率下降,最终导致YAP重定位,从而产生了干细胞分化的逆转现象。这项工作表明,力学效应可为调控间充质干细胞的力学感知和干性逆转/维持过程提供新途径。这是继该课题组揭示了整合素受体聚集依赖的细胞力学信号转导机制(Science Advance, 2020,封面论文)之后,在细胞生物力学研究领域的又一新进展。
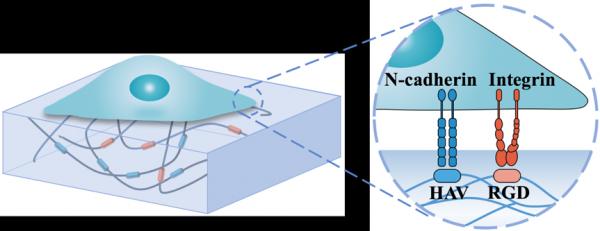
图1.整合素、钙黏素力敏感受体与配体的力学结
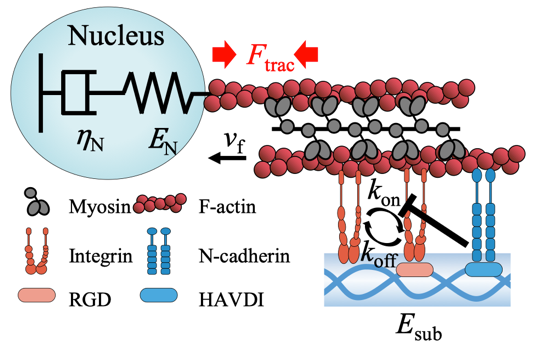
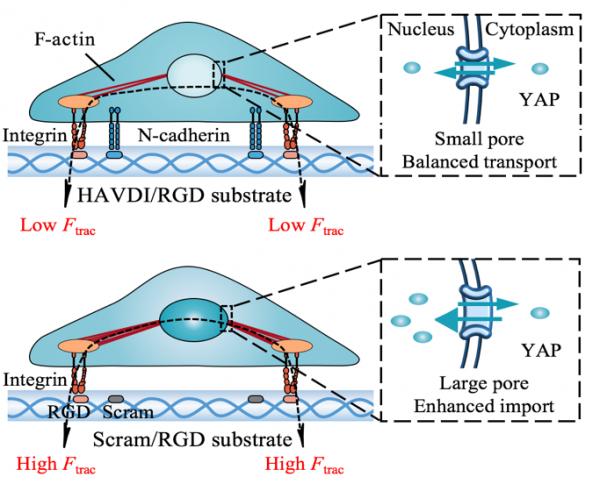
图2.基于细胞力敏感受体黏附拮抗效应的转录因子重定位模型
该研究成果以“N-钙黏素受体的力学结合可逆转间充质干细胞中力学驱动的YAP核定位”(Mechanics-driven nuclear localization of YAP can be reversed by N-cadherin ligation in mesenchymal stem cells)为题,在国际综合性期刊《自然通讯》(Nature Communications)上在线发表。西安交通大学生物医学信息工程教育部重点实验室为该论文的第一作者单位和通讯作者单位,博士生张诚和助理教授朱鸿源博士为第一作者,林敏教授为唯一通讯作者。该研究得到了卢天健教授、徐峰教授、吕毅教授、华盛顿大学圣路易斯分校Guy Genin教授等的大力协助。研究得到了国家自然科学基金、陕西省青年拔尖人才计划、西安交大青年拔尖人才支持计划、西安交通大学医工交叉项目等的共同资助,实验测试得到西安交大分析测试共享中心的支持。
林敏教授围绕细胞力敏感受体介导细胞功能调控的力学生物学机制这一科学问题,通过细胞力学微环境构建、表征,结合力学理论模型与细胞生物学实验开展了系列研究。近两年,在细胞生物力学领域开展了原创工作,代表性研究成果发表在《自然通讯》(Nature Communications)、《科学进展》(Science Advances)等权威期刊上。
论文链接:https://www.nature.com/articles/s41467-021-26454-x
林敏教授主页链接:https://gr.xjtu.edu.cn/en/web/minlin
 西电各学院举办建校90周年系列活动
西电各学院举办建校90周年系列活动 一起做更好的大学!来自90所兄弟高校的“云端”祝福
一起做更好的大学!来自90所兄弟高校的“云端”祝福