西安交大科研人员在消化疾病及肝脏病学领域研究取得进展
近日,西安交通大学第二附属医院普外科副研究员徐蒙,以合作研究者身份的研究论著《在肝癌发生中,TBX3是CTNNB1激活突变下游的抑癌因子》(TBX3 functions as a tumor suppressor downstream of activated CTNNB1 mutants during hepatocarcinogenesis)在国际著名肝脏学杂志《肝脏病学杂志》(Journal of Hepatology)以原创性论文收录。
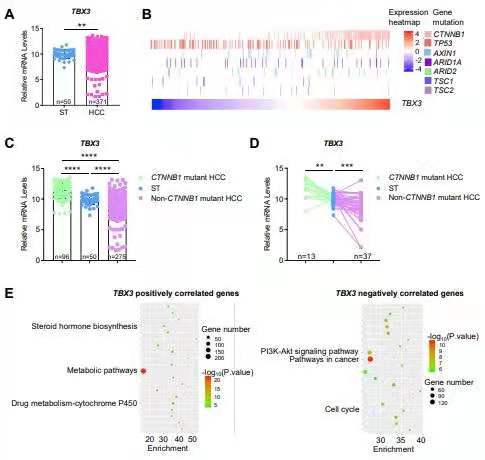
CTNNB1(编码β-catenin)基因的功能获得突变是肝细胞肝癌(HCC)中最常见的遗传学变异事件之一。T-box转录因子3 (TBX3)是肝脏中Wnt/β-catenin通路的特异性靶点,被认为是介导激活的β-catenin驱动的HCC形成中的一个致癌基因。研究通过评估TBX3在人HCC标本中的表达,在Tbx3flox/flox转基因小鼠中,通过尾静脉注射c-Met和ΔN90-β-catenin (c-Met/β-catenin)构建小鼠肿瘤模型。通过在小鼠HCC模型中条件敲除Tbx3,以及在人肝癌细胞株中过表达TBX3来具体研究TBX3在HCC形成中的功能和机制。研究发现,TBX3在人HCC标本中呈双峰表达模式:TBX3在CTNNB1激活突变的HCC中高表达,而在非CTNNB1突变的HCC肿瘤中表达下调。TBX3的高表达与肿瘤的高分化程度以及肿瘤生长较慢相关。
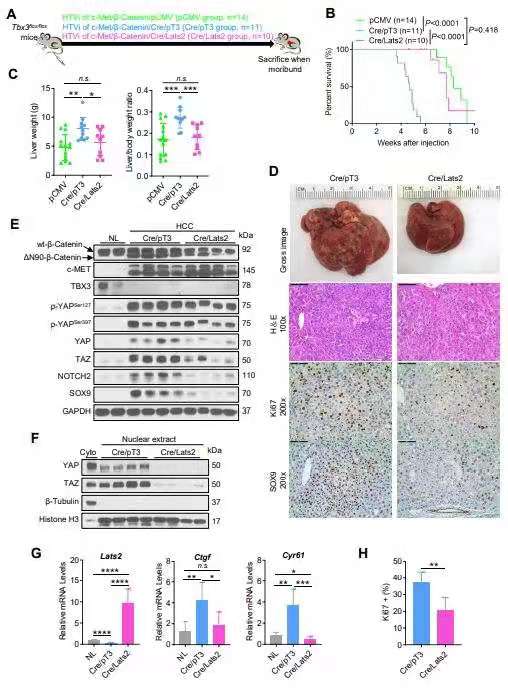
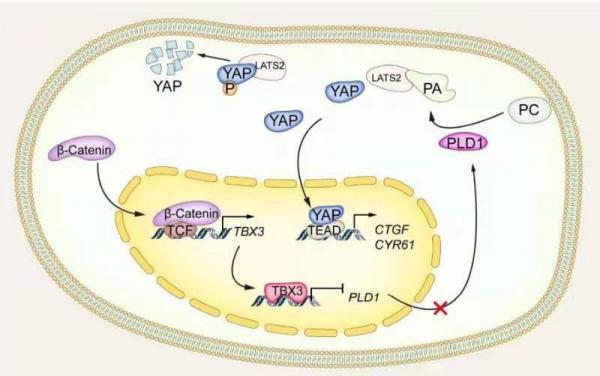
使用Tbx3flox/flox小鼠,研究发现Tbx3敲除后显著加速了c-Met/β-catenin驱动的HCC形成。此外,Tbx3阴性的小鼠HCC中显示了YAP/TAZ活性的增加。在c-Met/β-catenin诱导的小鼠HCC中,TBX3缺失诱导的肿瘤加速生长作用可以被LATS2的过表达成功阻止,而LATS2可以抑制YAP/TAZ的活性。在人HCC细胞系中,过表达TBX3可抑制肝癌细胞的生长和YAP/TAZ的激活。在人HCC样本中,TBX3与YAP/TAZ靶基因呈负相关。磷脂酶D1(PLD1)是已知的YAP/TAZ的正向调节因子,在此研究中被鉴定为是受TBX3负向调控的一个新的转录靶点。该研究表明TBX3可以被CTNNB1激活突变诱导上调并通过抑制PLD1,导致YAP/TAZ癌基因的功能受到抑制从而发挥减缓肝癌肿瘤生长的作用。TBX3是肝脏中Wnt/β-catenin通路的特异性靶点,被认为是促进肝癌发展的一个致癌基因。研究证明,TBX3实际上是一个抑癌基因,可以抑制肝脏肿瘤的生长。提高TBX3表达和/或其活性的治疗策略可能对HCC治疗有帮助。
《肝脏病学杂志》是消化疾病及肝脏病学领域最顶尖杂志之一,位列胃肠道及消化病学所有杂志中第二位,最新影响因子为25.083。该项研究成果在美国加州大学旧金山分校陈昕教授,德国雷根斯堡大学病理研究所的Diego F.Calvisi教授以及武汉华中科技大学同济医学院附属同济医院肝脏外科中心黄志勇教授指导下完成。武汉华中科技大学同济医学院附属同济医院肝脏外科中心梁宾勇博士是该文章的第一作者。西安交通大学第二附属医院普外科副研究员徐蒙参与了其中部分实验及写作工作。
论文链接:https://pubmed.ncbi.nlm.nih.gov/33577921/
 空间学院看望慰问暑假留校学生
空间学院看望慰问暑假留校学生 西电举办国家双创示范基地重点建设项目验收会
西电举办国家双创示范基地重点建设项目验收会